Vitamin D steuert in unserem Körper über 2000 Gene – doch wie genau funktioniert das? Dr. Carsten Carlberg von der University of Eastern Finnland forscht seit vielen Jahren zum Thema Vitamin D und Epigenetik. Seine Forschung hat nicht nur belegt, dass die in Zellversuchen beobachteten Effekte tatsächlich auf den Menschen übertragbar sind, sondern auch ganz andere Ergebnisse gebracht: Jeder Mensch reagiert auf der genetischen Ebene völlig unterschiedlich auf Vitamin D – und die „optimale Dosis“ Vitamin D ist höchst individuell. Wir haben mit Dr. Carlberg gesprochen.
Herr Carlberg, was genau ist eigentlich Epigenetik und wie beeinflusst sie unsere Gesundheit?
Jede Zelle unseres Körpers hat ein und dasselbe Genom. Dieses Genom ist verpackt in einem Komplex aus Nukleosomen, der Chromatin genannt wird. Diese Chromatin-Verpackung ist in jedem Zelltyp anders. Es gibt in unserem Körper etwa 400 verschiedene Zelltypen, die alle dasselbe Genom haben, aber trotzdem ganz unterschiedliche Aufgaben erfüllen. Der einzige Unterschied zwischen diesen ganz verschiedenen Zellen ist ihr Epigenom. Das bedeutet: Wir haben nur ein Genom, aber über 400 Epigenome. Das Epigenom ist also die Verpackung des Genoms und sorgt dafür, dass alle Gewebe ihre eigene Identität haben und diese auch behalten. Das Epigenom sorgt dafür, dass nicht alle 20.000 Gene unseres Genoms gleichzeitig aktiv sind, sondern steuert ganz genau wann und wo welche Gene aktiv sind.
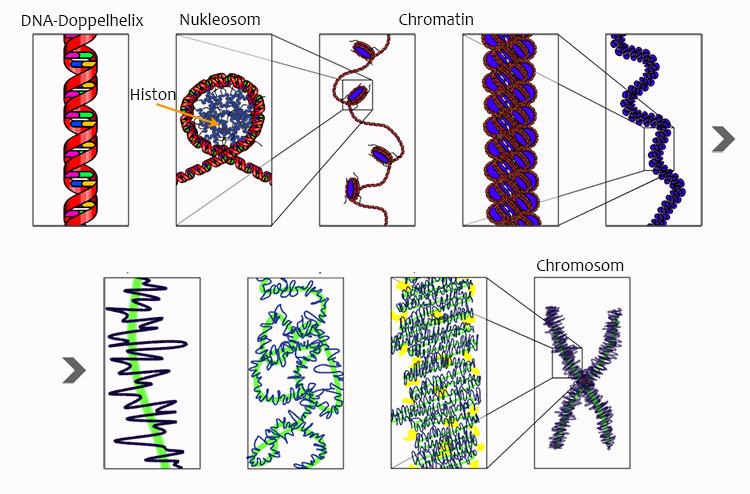
Und deshalb unterscheidet sich eine Leberzelle funktionell stark von einer Hautzelle, obwohl beide das genau gleiche Genom haben?
Ja und es sorgt auch dafür, dass eine Leberzelle sich nicht plötzlich in eine Hautzelle verwandelt und alle Gewebe ihre Identität dauerhaft behalten.
Wenn ich es richtig verstehe, können wir uns das so vorstellen, dass durch diese Verpackung, also die Faltung des Genoms, nur bestimmte Gene für die Zelle zugänglich sind, alle anderen aber nicht?
Ja, in jedem Zelltyp sind nur etwa 10 Prozent des gesamten Genoms zugänglich, aber diese 10 Prozent machen dann genau diesen Zelltyp aus. Wichtig ist, dass dabei nie das Genom selbst verändert wird, sondern eben nur seine Verpackung. Es gibt hier drei verschiedene Ebenen der Epigenetik, von denen die DNA-Methylierung die bekannteste ist. Ein weiterer Aspekt ist die sogenannten Histon-Modifikation. Histone sind die Proteine, welche die Nukleosomen formen und um diese Nukleosomen ist die genomische DNA herumgewickelt. Und zuletzt gibt es dann noch die dreidimensionale Faltung des Genoms in Schleifen als dritte Dimension des Epigenoms.
Die Epigenetik hat ja einerseits die schon angesprochene Funktion der Zelldifferenzierung, aber das Epigenom verändert sich ja auch ständig.
Ja, die Zelldifferenzierung geschieht einerseits schon während der Embryogenese, aber auch ein Leben lang, da sich viele Zellen unseres Körpers ständig erneuern. Diese neuen Zellen in der Haut, in der Darmschleimhaut und insbesondere im Knochenmark müssen natürlich auch klar differenziert sein. Das ist eine zelluläre Differenzierung, die nicht umkehrbar ist.
Aber dann gibt es noch eine ganz andere Ebene. Und das ist eine Ebene, wo das Epigenom dynamisch reagiert, auf Veränderungen, die ad hoc passieren. Jedes Mal, wenn in unserem Körper irgendein Gen anspringt, eine Gen-Transkription stattfindet, muss es vorher eine epigenetische Veränderung gegeben haben, die das Gen sozusagen „freigibt“. Es gibt keine Veränderung im Transkriptom, ohne dass sich vorher das Epigenom verändert. Das Epigenom reagiert dynamisch auf Veränderungen in unserer Umgebung, auf unsere Nahrung, ob wir gestresst sind, und auf alle möglichen Arten von Signalen.
Und da kommt auch Vitamin D ins Spiel?
Genau, Vitamin D ist eines der Signale, die unser Epigenom beeinflussen, genauer gesagt der Spiegel des Vitamin-D-Hormons.
Wie genau funktioniert das?
Dieser zweite, dynamische Teil der Epigenetik wird durch Signal-Transkriptionswege gesteuert. Das heißt, die Zelle wird von außen mit Signalen „beschossen“. Das können ganz unterschiedliche Signale und Botenstoffe sein, wie Zytokine, Peptidhormone oder eben nukleäre Hormone, wie die aktive Form von Vitamin D. Nukleäre Hormone wirken nicht an der Zellmembran, sondern gehen tatsächlich direkt in den Nukleus, wo sie das Epigenom verändern.
Am Ende einer Signal-Transkriptionskette steht ein sogenannter Transkriptionsfaktor. Einer dieser Transkriptionsfaktoren ist der Vitamin-D-Rezeptor. Der Vitamin-D-Rezeptor kommuniziert mit dem Epigenom und löst eine vorrübergehende Veränderung des Epigenoms aus.
Was genau bedeutet das für unsere Gesundheit?
Es bedeutet, dass sich unser gesamter Lebensstil auf diese Weise direkt im Epigenom niederschlägt. Das ist eine Art Gedächtnis. Unser Epigenom erinnert sich durch diese Veränderungen an alle Einflüsse, denen wir ausgesetzt waren – was wir gegessen haben, ob wir uns bewegt haben, oder eben nicht. Unser gesamter Lebensstil – nicht bloß das, was wir mental erinnern, sondern wirklich alles, was wir erfahren und machen oder nicht machen – schlägt sich im Epigenom der entsprechenden Gewebe nieder. Das ist ein Programmierungsprozess: Durch unseren Lebensstil programmieren wir buchstäblich die Zellen unseres Körpers. Wenn wir das gut machen, haben wir ein gesundes Leben bis ins hohe Alter. Wenn wir es falsch machen, bekommen wir schon sehr früh diverse Erkrankungen, wie Diabetes, Krebs und Ähnliches.
Der Großteil aller Krankheiten wäre vermeidbar durch eine gesunde epigenetische Programmierung.
Und Vitamin D ist ein wichtiger Faktor für eine gesunde epigenetische Programmierung?
Ja, Vitamin D trägt zur „richtigen“ Programmierung unseres Epigenoms bei. Zum Beispiel hilft Vitamin D, die Immunzellen so zu programmieren, dass sie besser reagieren und weniger chronische Entzündungen entstehen. Vitamin D ist ein epigenetischer Modulator, also eine der Substanzen, die unser Epigenom beeinflussen können – und im Falle von Vitamin D ist dieser Einfluss, soweit wir wissen, ausschließlich positiv.
Schon länger wissen wir aus Zellstudien, dass Vitamin D auf diese Weise etwa 2000 Gene beeinflusst. Ihre Forschergruppe hat dies nun durch in vivo-Studien – also an lebenden Menschen – untersucht. Inwiefern bestätigen diese in-vivo-Studien die Zellversuche und gab es dabei auch neue Erkenntnisse?
Insgesamt sollte solche Forschung viel mehr an lebenden Primärzellen stattfinden. Besonders einfach ist das bei Blutzellen, die man sehr einfach entnehmen kann. An solchen Zellen zu forschen ist wesentlich wichtiger, als die Forschung mit Zellkulturen, die eben doch sehr artifiziell ist und keine Gewissheit bietet, dass die gleichen Mechanismen so auch in vivo ablaufen. Es gibt nun seit einigen Jahren Ergebnisse aus großen Studien, den „Big-Biology“-Projekten wie Fantom5 oder Roadmap Epigenomics, die klar zeigen, dass man nur weiterkommt, wenn man mit primären humanen Zellen arbeitet – nur dann bekommt man einen wirklichen Einblick. Darum haben wir das Studiendesign einer Vitamin-D-Interventionsstudie gewählt. Dabei wurde den Probanden eine hohe einmalige Dosis Vitamin D3 gegeben und jeweils kurz vor dieser Dosis und einen Tag danach Blut abgenommen. Wir haben uns die Blutzellen daraufhin angeschaut, was auf der Ebene des Epigenoms und des Transkriptoms an Veränderungen zu beobachten ist. Und dabei haben wir tatsächlich eine große Anzahl an Veränderungen gesehen und konnten damit zeigen, dass die in den Zellversuchen beobachteten Veränderungen wirklich auch in einem humanen in-vivo-Versuch so passieren. Die in den Zellkulturen beobachteten Prinzipien gelten also auch im lebenden Menschen.
Welche Zellen wurden da genau untersucht?
Untersucht wurden PBMCs, das sind eine Mischung aus weißen Blutkörperchen, Monozyten, T- und B-Lymphozyten. Mit dieser Zellmischung zu arbeiten ist sehr viel einfacher, als die einzelnen Zelltypen zu isolieren. In der Summe dieser Zellen bewegen sich etwa 700 Gene innerhalb von 24 Stunden nach einer großen Dosis Vitamin D.
Gab es dabei Überraschungen, welche Gene beeinflusst wurden?
Viele der Gene kannten wir schon aus den Zellkulturversuchen, das war also eher eine gute Bestätigung der in-vitro-Versuche. Wir haben aber auch eine ganze Reihe neuer Gene gefunden, bei denen wir erstmal untersuchen müssen, was es eigentlich bedeutet, dass sich diese Gene durch Vitamin D bewegen.
Eine Wirkung des Vitamin D ist ja der Einfluss auf den Calcium-Stoffwechsel und die Knochengesundheit. Offizielle Stellen wie das IOM erkennen bisher kaum an, dass Vitamin D vielleicht sogar noch wichtigere Funktionen in vielen anderen Bereiche unserer Gesundheit hat – welche Aufschlüsse geben hier die aktuellen genetischen Studien?
So darf man das nicht sagen. Sie müssen das evolutionär betrachten. Es gibt ja den Spruch: „Nichts macht Sinn, wenn es keinen evolutionären Sinn macht“. Vitamin D funktioniert über einen nukleären Rezeptor. Nukleäre Rezeptoren haben während der Evolution gelernt, bestimmte Funktionen zu übernehmen, indem sie auf den ein oder anderen Liganden reagieren – in diesem Falle eben die aktive Form von Vitamin D. Die evolutionär erste Funktionen nukleärer Rezeptoren ist die Regulation des Metabolismus – wie eben die Calcium-Homöostase das Spezialgebiet von Vitamin D geworden ist. Das IOM hat also Recht, dass die metabolische Funktion des Vitamin D, nämlich den Calcium- und Phosphat-Stoffwechsel zu kontrollieren, vermutlich immer noch die wichtigste Funktion von Vitamin D ist. Parallel dazu haben sich aber neue Funktionen für dieser Rezeptoren entwickelt. Der zelluläre Metabolismus und das Immunsystem sind sehr viel stärker miteinander verwoben sind, als bisher angenommen. Und weil hier eine so enge Verbindung besteht, hat sich die Funktion des Vitamin-D-Rezeptors eben auch auf das Immunsystem ausgeweitet. Das ist kein Gegensatz zur metabolischen Funktion, sondern evolutionär betrachtet eine natürliche Konsequenz. Calcium-Homöostase und Immunsystem sind die Hauptfunktionen von Vitamin D und alles andere ergibt sich als Konsequenz und Effekt dieser beiden Funktionen.
Wenn man sich nun anschaut, was Vitamin D auf der epigenetischen Ebene macht, lassen sich daraus direkte Schlüsse ziehen, welche Wirkungen dies im Organismus hat?
Da wir uns in unserer Studie Immunzellen angeschaut haben, war es klar, dass am Ende immunologische Effekte zu erwarten waren. Hätten wir uns Herzzellen angeschaut, wäre das vielleicht anders gewesen. Die Erkenntnisse hängen also von dem System ab, das man sich anschaut. Da wir aber ja wussten, dass das Immunsystem einer der wichtigen Wirkbereiche des Vitamin D ist, war es natürlich folgerichtig, auch in diesem System zu forschen. Letztlich haben wir genau das gefunden, was wir erwartet haben: Nämlich, dass wichtige Gene des Immunsystems, wie zum Beispiel die Gene des HLA-Lokus, durch Vitamin D reguliert werden.
Im Grunde haben wir die Wirkung des Vitamin D in diesem Bereich also nun in drei Ebenen erforscht: Durch epidemiologische Studien, durch Zellversuche und nun durch epigenetische Studien. Wissen wir denn jetzt genau, wie das funktioniert?
So ganz genau wissen wir es leider immer noch nicht, aber wir sind einen guten Schritt weiter, das mechanistisch zu entschlüsseln, ja.
Wie würden sie den aktuellen Forschungstand zu Vitamin D zusammenfassen?
Ich denke, in den folgenden vier Statements 1) Jeder ist durch seinen Lebensstil auf epigenetischer Ebene für die Entstehung von Krankheiten selbst mit verantwortlich. 2) Vitamin D hat zwei gesicherte Funktionen: Die Regulation des Calcium-Phosphat-Stoffwechsels und die Modulation des Immunsystems. Mehr ist derzeit nicht gesichert. Es gibt leider viele Menschen, die Vitamin D zu sehr in den Himmel heben. Vitamin D ist einer von sehr vielen Botenstoffen, sicher einer der wichtigsten, den man gut unter Kontrolle haben sollte. Aber 3) Vitamin D ist kein Wundermittel. Es gibt keinen Botenstoff, der alle Bereiche unserer Gesundheit reguliert oder gegen jede Krankheit hilft. Tatsächlich sollte man Vitamin D überhaupt nicht wie ein Medikament betrachten, denn 4) Vitamin D ist für die Prävention gedacht, nicht für die Therapie. Ich denke Vitamin D hat ein großes Potenzial in der Prävention, aber es gibt derzeit wenig gute Belege dafür, dass Vitamin D auch ein großes therapeutisches Potenzial hat.
Vitamin D wird also überbewertet?
Nein, Vitamin D ist sehr wichtig, aber eben kein Wundermittel. Ich argumentiere immer so: Wenn ich einem Europäer ins Gesicht blicke, dann ist er hellhäutig. Und allein diese Tatsache sollte uns zeigen, wie wichtig Vitamin D für den Körper ist. Denn wenn es nicht wichtig gewesen wäre, hätte es diese Selektion nicht gegeben und wir wären heute immer noch so dunkelhäutig wie vor Tausenden von Jahren, als wir aus Afrika aufgebrochen sind. Wir haben im Wesentlichen immer noch das Genom des Steinzeitmenschen und Vitamin D war einer der wenigen Selektionsfaktoren, der eine wirklich substanzielle Veränderung hervorgerufen hat.
Dann lassen Sie uns noch einen anderen Bereich besprechen, denn ein zweites spannendes Ergebnis ihrer Studie ist, dass die epigenetischen Auswirkungen einer bestimmten Dosis Vitamin D individuell extrem unterschiedlich sind. Sie sprechen hier von einem „Vitamin-D-Response-Index“ – was genau ist das?
Die Idee des Response-Index kommt aus dem pharmakologischen Bereich, wo zu beobachten ist, dass Menschen unterschiedlich stark auf ein Medikament reagieren. Man teilt hier ein in Low-, Mid- und High-Responders. Dieses Prinzip ist für viele Stoffe zu erwarten und wir konnten in unseren Studie zeigen, dass es auch für Vitamin D zutrifft. Es gibt Menschen, die sehr sensitiv auf Vitamin D reagieren, hier reichen schon kleinste Mengen, um das Vitamin-D-System optimal zu beeinflussen – das sind die sogenannten High-Responder. Auf der anderen Seite gibt es aber auch Menschen, die sehr große Dosen Vitamin D benötigen, um denselben Effekt zu erzielen – das sind die Low-Responder.
Die Vitamin-D-Versorgung wird ja momentan anhand des Vitamin-D-Spiegels beurteilt. Wenn es stimmt, was Sie sagen, würde das doch aber bedeuten, dass wir die Wirkung von Vitamin D weder an der Dosis, noch am Blutspiegel festmachen können, sondern einzig an der individuellen epigenetischen Reaktion, die sehr individuell ist.
Genau. Wir müssen eigentlich in die Zellen schauen, was sich da epigenetisch tatsächlich bewegt.
Welche Aussagekraft hat denn dann der Blutspiegel? Gab es in ihrer Studie da überhaupt Entsprechungen zwischen Spiegel und epigenetischer Reaktion?
Nein, der Spiegel hatte in unserer Studie keine große Korrelation zur epigenetischen Reaktion.
Dass heißt, ein Mensch mit einem Spiegel von 25 ng/ml könnte die gleiche epigenetische Reaktion zeigen, wie jemand anders erst mit einem Spiegel von 80 ng/ml?
Genau. Und das bedeutet auch: Wenn ein High-Responder im Winter einen mangelhaften Blutspiegel aufweist, hat dies vermutlich keine dramatischen Auswirkungen. Für diesen Menschen wären auch keine großen täglichen Dosen während des Winters nötig, um die physiologische Funktion des Vitamin D aufrecht zu erhalten.
Wie groß ist denn da der Unterschied?
Genau ist das nicht quantifiziert. Aber einem High-Responder könnten vielleicht 1000 IE (25 µg) genügen, ein Low-Responder bräuchte eher um die 4000 IE (100 µg).
Wissen wir irgendetwas darüber, wie diese Gruppen in der Bevölkerung ungefähr verteilt sind?
Wir haben bisher etwa 150 Menschen in unseren Studien untersucht, in sehr verschiedenen Altersgruppen und mit verschiedenen ethnischen Zugehörigkeiten. Dabei stellte sich immer heraus, dass etwa 25 Prozent, also ein Viertel der Teilnehmer Low-Responder sind. Also etwa jeder Vierte Mensch braucht recht viel Vitamin D, um eine ausreichende Wirksamkeit zu erreichen.
Aber gibt es denn eine Chance, selbst einzuschätzen, zu welcher Gruppe man gehört?
Momentan nicht. Eigentlich müsste die Response-Index-Messung in irgendeiner Weise automatisiert werden, damit man sie der Öffentlichkeit anbieten kann. Dieser Test muss ja vermutlich nur einmal gemacht werden. Und ein Low-Responder wüsste dann, dass er wirklich den Rest seines Lebens im Winter supplementieren muss – mit vernünftigen Dosen!
Was ist denn die Erklärung für diese unterschiedlichen Reaktionen?
Das wissen wir derzeit leider noch nicht. Das Vitamin-D-System ist sehr komplex. Wir würden da sehr gerne weiterforschen und versuchen gerade, von einem EU-Konsortium die entsprechenden Forschungsgelder zu bekommen…
Was wäre dann ihre nächste Studie?
Wir würden gerne eine größere Gruppe Menschen untersuchen. Vor allem Menschen mit entzündlichen Erkrankungen wie Morbus Crohn oder Reizdarmsyndrom. Meine Hypothese wäre, dass unter diesen Menschen ein größerer Anteil an Low-Respondern zu finden sein wird, und diese Menschen die Krankheit deshalb bekommen haben, weil sie eben so schlecht auf Vitamin D reagieren. Das würden wir gerne überprüfen.
Dabei würden wir gleichzeitig nochmal sehr viele Daten gewinnen, weil wir uns natürlich das ganze Epigenom und Transkriptom anschauen würden. Aus diesen Datensätzen würde sich hoffentlich ein Muster zeigen, dass uns auch Aufschluss über die mechanistische Ursache des Response Index liefern kann. Wir haben hier derzeit einfach noch nicht genügend Daten, um eine klare Antwort zu geben.
Wie schätzen Sie die Bedeutung dieser Entdeckung ein? Die gesamte Vitamin-D-Forschung bisher arbeitet ja mit standardisierten Dosen…
Es wäre natürlich schön gewesen, wenn die großen Studien, die gerade beendet wurden und die leider keine überzeugenden Ergebnisse geliefert haben, den Response Index mitberücksichtigt hätten. Dann hätte man sich bevorzugt die Low-Responder heraussuchen können, die besonders von einer Vitamin-D-Supplementation profitieren. Die High-Responder verwässern die Ergebnisse solcher Studien natürlich extrem. Und das ist traurig, denn diese Studien haben Millionen gekostet und sind vom Design her leider immer noch so suboptimal, dass wir dadurch keine klaren Antworten bekommen – und dass Vitamin D leider nicht gut weggekommen ist, in diesen Studien.
Was sind denn ihre Empfehlungen? Etliche Menschen sind nun vielleicht verunsichert und fragen sich, ob sie vielleicht zu viel oder zu wenig Vitamin D nehmen…
Einige Kollegen warnen ja vor hohen Dosen Vitamin D – zu diesem Lager gehöre ich nicht. Hier bei uns in Finnland ist der Vitamin-D-Winter mindestens 5 Monate lang, während dieser Zeit sollte man täglich mindestens 4000 IE (100 µg) zu sich nehmen. Der High-Responder hat damit vermutlich schon etwas zu viel, was aber nichts macht, und auch der Low-Responder dürfte ausreichend versorgt sein. Die offiziellen Empfehlungen von 800 IE (20 µg) sind meiner Ansicht nach absolut nicht ausreichend. Das ist für viele Menschen, insbesondere die Low-Responder viel zu niedrig.
Sie würden also sagen, mit den offiziellen Empfehlungen sind alle Low- und Mid-Responder nicht ausreichend versorgt?
Ja, richtig. Und das sind mindestens 50 Prozent der Bevölkerung. Aber da in den entsprechenden Studien alle in einen Topf geworfen werden, verdünnen die High-Responder die Ergebnisse – und so kommt es zu solchen unzureichenden Empfehlungen.
Sie empfehlen eine tägliche Supplementation – ihrer Studie haben sie aber mit einer Bolus-Gabe durchgeführt…
Die Studie haben wir nur deshalb mit einer Bolus-Dosis durchgeführt, weil der Effekt so einfacher zu messen ist. Auf diese Weise konnten wir sicher sein, dass das, was wir da sehen, wirklich die direkten Effekte des Vitamin D sind. Außerdem werden die meisten Blutzellen nur wenige Tage oder Wochen alt und wie wollten ja wirklich direkte Effekte an den gleichen Zellpopulationen messen.
Aber für die Bedarfsdeckung würde ich auf jeden Fall empfehlen, täglich die gleiche Menge zu nehmen, statt wöchentliche oder monatliche Bolus-Dosen. Das Vitamin-D-System ist sehr sensibel, Vitamin D ist ein Hormon für die Homöostase. Im Gegensatz zu beispielsweise den Östrogenen, die bei Frauen im Monatsrhythmus rauf und runter gehen, ist das Vitamin-D-System auf einen konstanten Grundspiegel angelegt. Vitamin D ist ein Hormon, dass sich normalerweise eben ausdrücklich nicht ständig verändern sollte. Ein Bolus verursacht einen scharfen Peak, den man bei Vitamin D eigentlich nicht haben möchte. Deshalb auf jeden Fall eine tägliche Supplementation für die Bedarfsdeckung.
Vielen Dank für das Gespräch!
Studien zum Thema:
Neme A, Seuter S, Malinen M, Nurmi T, Tuomainen T-P, Virtanen JK, Carlberg C (2018) In vivo transcriptome changes of human white blood cells in response to vitamin D. The Journal of Steroid Biochemistry and Molecular Biology. doi: 10.1016/j.jsbmb.2018.11.019 DOI: 10.1016/j.jsbmb.2018.11.019
Carlberg C, Seuter S, Nurmi T, Tuomainen T-P, Virtanen JK, Neme A (2018) In vivo response of the human epigenome to vitamin D: A Proof-of-principle study. The Journal of Steroid Biochemistry and Molecular Biology 180:142–148 DOI: 10.1016/j.jsbmb.2018.01.002
Carlberg C (2018) Vitamin D genomics: from in vitro to in vivo. Front Endocrinol. doi: 10.3389/fendo.2018.00250 DOI: 10.3389/fendo.2018.00250
Carlberg C, Haq A (2018) The concept of the personal vitamin D response index. J Steroid Biochem Mol Biol 175:12–17 PMID: 28034764


